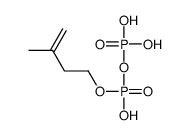
La isopentenil pirofosfato Δ isomerasa (IPP isomerasa), también conocida como isopentenil difosfato delta isomerasa, es una isomerasa que cataliza la conversión del pirofosfato de isopentenilo relativamente no reactivo (IPP) al pirofosfato de dimetilalilo electrófilo más reactivo (DMAPP). Esta isomerización es un paso clave en la biosíntesis de isoprenoides a través de la vía de mevalonato y la vía de MEP. Cataliza la siguiente reacción:[1]
- pirofosfato de isopentenilo --> pirofosfato de dimetilalilo
Esta enzima pertenece a la familia de las isomerasas, específicamente aquellas oxidorreductasas intramoleculares que transponen enlaces C = C. El nombre sistemático de esta clase de enzimas es isopentenil-difosfato Delta3-Delta2-isomerasa. Otros nombres de uso común incluyen isopentenilpirofosfato Delta-isomerasa, metilbutenilpirofosfato isomerasa e isopentenilpirofosfato isomerasa.[2][3][4]
Mecanismo de enzima
La isomerasa de IPP cataliza la isomerización de IPP a DMAPP mediante una transposición antarafacial de hidrógeno. La evidencia empírica sugiere que esta reacción se desarrolla mediante un mecanismo de protonación / desprotonación, con la adición de un protón a la cara del doble enlace C3-C4 inactivado que da como resultado un intermedio de carbocatión transitorio. La eliminación del protón pro-R de C2 forma el doble enlace C2-C3 de DMAPP.[5][6][7][8]
Estructura enzimática
Los estudios cristalográficos han observado que la forma activa de la isomerasa IPP es un monómero con hélices α y láminas β alternas. El sitio activo de la isomerasa de IPP está profundamente enterrado dentro de la enzima y consiste en un residuo de ácido glutámico y un residuo de cisteína que interactúan con lados opuestos del sustrato de IPP, de acuerdo con la estereoquímica antarafacial de la isomerización. El origen del paso de protonación inicial no se ha establecido de manera concluyente. La evidencia reciente sugiere que el residuo de ácido glutámico está involucrado en la etapa de protonación a pesar de la observación de que su cadena lateral de ácido carboxílico se estabiliza en su forma de carboxilato. Esta discrepancia se ha abordado mediante el descubrimiento de una molécula de agua en el sitio activo de la isomerasa de IPP humana, lo que sugiere un mecanismo donde el residuo de glutamina polariza el doble enlace de IPP y lo hace más susceptible a la protonación por agua..[9][10][11][12][13]
La isomerasa de IPP también requiere un catión divalente para plegarse en su conformación activa. La enzima contiene varios aminoácidos, incluido el glutamato catalítico, que participan en la coordinación con Mg 2 o Mn 2. La coordinación del catión metálico con el residuo de glutamato estabiliza el intermedio de carbiocación después de la protonación.[9][14]
Estudios estructurales
Hacia el 2007, 25 estructuras han sido solucionadas para esta clase de enzimas, con códigos de accesión PDB 1HX3, 1HZT, 1I9A, 1NFS, 1NFS, 1OW2, 1P0K, 1P0K, 1PPV, 1PPV, 1PVF, 1Q54, 1R67, 1VCF, 1VCF, 1X83, 1X83, 2B2K, 2DHO, 2G73, 2G73, 2I6K, 2ICJ, 2I6K, y 2PNY.
Función biológica
La protonación de un doble enlace inactivado rara vez se ve en la naturaleza, destacando el mecanismo catalítico único de la isomerasa IPP. La isomerización de IPP a DMAPP es un paso crucial en la síntesis de isoprenoides y derivados de isoprenoides, compuestos que desempeñan papeles vitales en las vías biosintéticas de todos los organismos vivos. Debido a la importancia de la vía del melavonato en la biosíntesis de isoprenoides, la isomerasa IPP se encuentra en una variedad de compartimentos celulares diferentes, incluidos los plastidios y las mitocondrias de mamíferos.[15][16]
Relevancia patológica
Las mutaciones en IDI1, el gen que codifica la IPP isomerasa 1, se han implicado en una disminución de la viabilidad en varios organismos, incluida la levadura Saccharomyces cerevisiae, el nematodo Caenorhabditis elegans y la planta Arabidopsis thaliana. Si bien no ha habido evidencia que implique directamente las mutaciones IDI1 en la enfermedad humana, el análisis genómico ha identificado una ganancia en el número de copias cerca de dos genes de isomerasa IPP en una proporción sustancial de pacientes con esclerosis lateral amiotrófica esporádica, lo que sugiere que la isomerasa puede desempeñar un papel relevante en esta enfermedad..[17][18][19][20]
Referencias